Identificação de reações de oxidação-redução através da variação dos números de oxidação
Podemos agora definir as reacções desoxidação-redução, ou redox, através dos números de oxidação.
Toda a reacção de oxidação-redução decorre com variação dos números de oxidação de alguns
átomos que nela participam.
Assim,
·
Um
átomo oxida-se quando o seu número de oxidação aumenta.
Oxidação – processo em que há aumento de nox.
- Um
átomo reduz-se quando o seu número de oxidação diminui.
Redução processo em que há diminuição de nox.
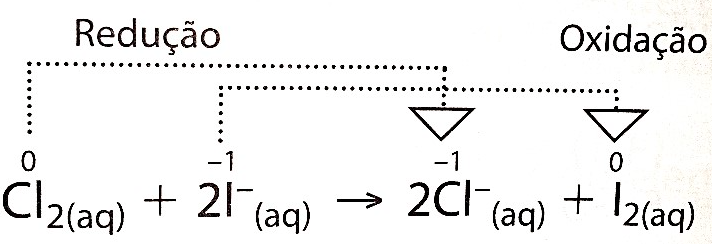
Exemplo:
O número de oxidação do Cloro passou
de 0 a –1:
O número de oxidação do Cloro
diminuiu: o Cloro reduziu-se.
O número de oxidação do iodo passou de
–1 a 0.
Como o número de oxidação aumentou, o
iodo oxidou-se.
Na equação:
+2 -2 0 +2 -2 0
ZnO + Mg → MgO + Zn
1. A semi-equação da reacção de
redução é:
+2 0
Zn2+ → Zn
O nox diminui.
2. A
semi-equação da reacção
de oxidação é:
0 +2
Mg
→ Mg2+ O nox aumenta.
3. Ainda
na reacção,
+2 -2 0 +2 -2 0
ZnO + Mg → MgO + Zn
O ião Zn2+ (no composto
ZnO) é oxidante,
pois diminuiu
o seu nox. O magnésio redutor aumentou o seu nox para Mg2+.
Bibliografia
SILVA, Filomena Neves. Q9 – Química 9ª Classe. 2ª Edição. Texto
Editores, Maputo, 2017.
FONTE: Escola Virtual Moçambicana> Disponível escolamz.com. Publicado aos: 2024-09-22 05:25:00